丂丂丂丂丂丂丂丂丂丂丂丂丂恖憿怓慺偺幚尡
丂丂侾丏丂僼僞儗僀儞怓慺偺幚尡丗
丂丂乮侾乯丂僼僃僲乕儖僼僞儗僀儞偺嶌惉丗
丂丂僼僞儗僀儞宯怓慺偺嵟傕婎杮揑側傕偺偲偟偰丄僼僃僲乕儖僼僞儗僀儞 乮俠20俫14俷4丄俵亖俁侾俉丏俁丄倣倫丏佮俀俇侽亷丄兿侾丏俀俉丄敀怓暡枛丄悈偵晄梟丄傾儖僐乕儖偵堈梟乯偑嫇偘傜傟傞丅 僼僃僲乕儖僼僞儗僀儞偼丄埨掕側怓慺偱偼側偔丄嫮傾儖僇儕惈椞堟偱 愒峠怓傪帵偡 倫俫巜帵栻乮倫俫亙俉丏俁 柍怓丄俉丏俁亙倫俫亙侾侽丏侽 僺儞僋丄侾侽丏侽亙倫俫亙侾俁丏係 愒峠怓丄侾俁丏係埲忋偱偼嵞傃柍怓偲側傞乯偲偟偰梡偄傜傟傞丅丂庛傾儖僇儕堟乮僺儞僋乯偱偺峔憿偼丄僩儕僼僃僯儖儊僞儞峔憿偱偁傝丄僼僋僔儞怓慺乮峠怓乯偲摨偠傛偆偵側傞乮伀塃丄 僩儕僼僃僯儖儊僞儞宯怓慺偵暘椶偝傟傞偙偲傕偁傞乯丅丂僼僃僲乕儖俀暘巕偲 柍悈僼僞儖巁侾暘巕偑 扙悈弅崌偟偰摼傜傟傞丅丂僼僃僲乕儖僼僞儗僀儞偼丄倫俫巜帵栻偲嫟偵丄侾悽婭埲忋傕偺挿偄娫丄壓嵻偲偟偰偺梡搑偑偁偭偨丅丂僼僃僲乕儖僼僞儗僀儞偺奺庬偺桿摫懱偼丄倫俫巜帵栻偺堦孮偲偟偰梡偄傜傟偰偄傞丅乮僼僃僲乕儖儗僢僪丄僠儌乕儖僽儖乕丄僽儘儉僠儌乕儖僽儖乕丄側偳乯
丂丂僼僃僲乕儖乮俠6俫5俷俫丄俵亖俋係丏侾丄倐倫丏侾俉侾丏俈亷丄倣倫丏係侽丏俆亷丄兿侾丒侽俈乯 俆丏俈倗丄 柍悈僼僞儖巁乮俠8俫4俷3丄俵亖侾係俉丏侾丄倣倫丏侾俁侾亷丄兿侾丏俆俁乯 俁倗丄 擹棸巁 俀倣倢 傪侾侽侽cc偺僼儔僗僐偵擖傟丄侾侾俆乣侾俀侽亷偺僆僀儖僶僗偱 俇帪娫 帪乆奾漚偟側偑傜壛擬偡傞丅 帪乆丄僼儔僗僐撪偺塼昞柺偵僈儔僗娗偱懅傪悂偒崬傫偱 悈暘傪摝偑偡丅
丂丂俇帪娫宱偭偨傜丄彮検偺僄僞僲乕儖偵梟偐偟偰丄侾侽侽倣倢掱搙偺悈拞偵擖傟偰奾漚偟偰丄側傞傋偔嵶偐偔暘嶶偡傞傛偆偵偡傞丅 偙傟傪嵞傃僼儔僗僐偵擖傟偰壛擬偟丄悈忲婥偲嫟偵 枹斀墳偺僼僃僲乕儖傪忲棷偟嫀傞丅 乮偙傟傪悢夞孞傝曉偡乯丂暘嶶偟偨嵶偐偄棻巕偼 媧堷傠夁偟偰丄愻忩丄姡憞偡傞丅丂廂検丗丂乮偐側傝偺晹暘傪幪偰偨偺偱乯 栺侽丏俈倗丅
丂丂斀墳偑抶偄偺偱丄壛擬帪娫偼俀係帪娫埲忋偵偡傞偺偑傛偄偲巚傢傟傞丅丂乮壏搙惂屼婍偼丄揹巕岺嶌係俋丏儊僞儖丒僶僗峆壏憛 傪梡偄偨乯
丂丂丂丂丂
丂

丂

丂丂廂検偑彮側偐偭偨偺偱丄師偼丄 僼僃僲乕儖 俁倗丄 柍悈僼僞儖巁 俁倗丄 柍悈墫壔垷墧 俁倗 偲偟丄柍悈僼僞儖巁傪夁忚偵偟偰 嬌椡枹斀墳偺僼僃僲乕儖傪尭傜偡傛偆帋傒偨丅 夁忚偺柍悈僼僞儖巁偼悈偲嫟偵幭暒偡傞偲壜梟惈偺僼僞儖巁偵壛悈暘夝偝傟傞丅丂傑偨丄棸巁偺戙傢傝偵墫壔垷墧傪梡偄傞偺偼丄崅壏偵偟偰斀墳懍搙傪懍傔偰傕棸巁偺傛偆偵偼暘夝偟側偄偨傔丅丂儊僞儖僶僗偱侾俉侽亷慜屻偱丄帪乆奾漚偟側偑傜 俁帪娫壛擬偟偨丅
丂丂斀墳暔傪 侾侽亾掱搙偺悈巁壔僫僩儕僂儉梟塼偵梟偐偟丄棸巁傪壛偊偰 僼僃僲乕儖僼僞儗僀儞傪暘嶶愅弌偝偣偨丅 彍嫀偟偵偔偄僼僃僲乕儖偼彮側偄丅丂媧堷傠夁丄姡憞屻偺廂検丗丂栺俀倗丅丂怓偼丄奃怓偱丄僞乕儖暘傗僼僃僲乕儖側偳偺晄弮暔偑擖偭偰偄傞丅丂堦墳丄傾儖僇儕惈偵偡傞偲丄傢偢偐側検偱嫮偄峠怓偑弌傞偺偱丄惈擻揑偵偼巊梡壜擻偲巚傢傟傞丅

丂丂乮俀乯丂僼儖僆儗僙僀儞偺嶌惉丗丂丂丂丒丒丒丂儊僞儖僶僗傪巊偭偰乭僶僗僋儕儞乭傪嶌傞丠
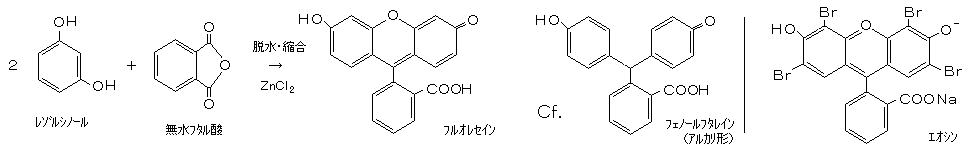
丂丂僼儖僆儗僙僀儞乮俵亖俁俁俀丏俁丄倣倫丏俁侾俆亷丄倫俲倎俇丏係丄悈偵晄梟丄擬僄僞僲乕儖丄恷巁偵堈梟乯偼丄俀暘巕偺 儗僝儖僔僲乕儖偲丄侾暘巕偺 柍悈僼僞儖巁偑 扙悈丒弅崌偟偰嶌傜傟傞丅 媧廂嬌戝偼兩亖係俋係値倣丄 曻幩岝偺攇挿乮悈拞乯偼 兩亖俆俀侾値倣 乮倫俫俆乣俋乯偱丄惵怓偱椼婲偝傟 椢怓偺寀岝傪曻幩偡傞丅丂僼儖僆儗僙僀儞偲偦偺桿摫懱偼丄寀岝儁儞偺僀儞僋傗丄惗暔嵶朎偺愼怓丄乭僶僗僋儕儞乭側偳偺擖梺嵻摍偵梡偄傜傟偰偄傞丅
丂丂儗僝儖僔僲乕儖乮倣乚俠6俫4乮俷俫乯2丄俵亖侾侾侽丏侾丄倣倫丏侾侾侾亷丄倐倫丏俀俉俀亷丄悈丄僄僞僲乕儖偵堈梟乯 係丏係倗丄 柍悈僼僞儖巁乮俵亖侾係俉丏侾丄倣倫丏侾俁侾丏俉亷乯 俁倗丄 墫壔垷墧乮倅値俠倢2乯 俀倗丂傪丄懢帋尡娗偵擖傟丄帪乆奾漚偟側偑傜 俀侾侽亷掱搙偱 俀帪娫壛擬偡傞丅乮奾漚偡傞偲暒摣偟丄懍傗偐偵悈暘偑忲敪偟偰斀墳偑恑傓乯
丂丂斀墳屻偼丄昘恷巁 侾侽倣倢傪壛偊偰壛擬偟偰拪弌丅偙傟傪俀夞峴側偄丄嵟屻偵擬僄僞僲乕儖侾侽倣倢偱拪弌偡傞丅丂拪弌塼傪崌傢偣偰丄俁侽侽倣倢掱搙偺悈偵搳擖偟丄堦搙幭暒偟偰偐傜丄傠夁偡傞丅丂偝傜偵丄傠夁暔傪傕偆堦搙幭暒丄傠夁偟丄姡憞偡傞丅丂乮儗僝儖僔僲乕儖偼悈偵堈梟偱丄柍悈僼僞儖巁傕幭暒偵傛偭偰悈梟惈偺僼僞儖巁偵側傞偺偱丄僼僃僲乕儖僼僞儗僀儞偲斾傋偰丄暘棧偼梕堈丅乯丂廂検丗丂栺係丏俆倗丅
丂丂仏丂僼儖僆儗僙僀儞傪恷巁偵梟夝偟丄廘慺傪嶌梡偝偣傞偲丄愒僀儞僋偺惉暘偺 僄僆僔儞偑偱偒傞丅丂寴楽搙偼傗傗掅偄偑丄梤栄丒對丒攠愼傕傔傫偵愒怓偺愼怓梡丅
丂

丂丂俀丏丂儖儈僲乕儖偺幚尡丗
丂丂乮侾乯丂俁乚僯僩儘僼僞儖巁偺嶌惉丗丂丂徤巁丄棸巁 庢埖拲堄
丂丂傑偢 柍悈僼僞儖巁偵 崿巁傪嶌梡偝偣偰丄儖儈僲乕儖偺慜嬱懱偺 俁乚僯僩儘僼僞儖巁乮俵亖俀侾侾丏侾丄倣倫丏俀侾侽亷乯傪嶌惉偡傞丅
丂丂柍悈僼僞儖巁乮俵亖侾係俉丏侾丄倣倫丏侾俁侾丏俉亷乯 俁侽倗丄 擹徤巁乮俫俶俷3丄俇侽亾丄兿侾丏俁俉乯 俀俉倣倢丄 擹棸巁乮俫2俽俷4丄俋俈亾丄兿侾丏俉係乯 俀俉倣倢丂傪丄俀俆侽們們僼儔僗僐偵擖傟丄惂屼梡壏搙寁乮敀嬥僙儞僒乯傪擖傟丄俶俷2攔婥梡偺娗傪晅偗丄侾俀侽亷埲忋偵忋偘側偄傛偆偵拲堄偟偰丄侾侾侽亅侾俀侽亷偱 俀帪娫敿乮帪乆怳傝崿偤側偑傜乯壛擬偟偰丄僯僩儘壔偡傞丅乮弶婜偺斀墳偱壏搙偑忋偑傞偺偱丄昁梫偵墳偠偰僼儔僗僐傪椻悈偱椻傗偡乯 懡偔偺敀偄捑揳偑偱偒偰偒偨傜丄椻媝屻丄彮偟偢偮 俈俆倣倢偺椻悈偵搳擖偟丄堦斢抲偄偰丄偝傜偵壛悈暘夝偟丄俶俷2傪敪惗偝偣傞丅
丂丂偙傟傪傠夁偟丄傠夁暔傪 偱偒傞偩偗彮検偺擬悈偵梟偐偟丄曻椻偟偰丄俁乚僯僩儘僼僞儖巁乮梟夝搙丗 俆亾乮幒壏乯丄擬悈丒僄僞僲乕儖偵梟乯偩偗傪徎弌偝偣乮寢徎壔偵帪娫偑偐偐傞乯丄傠夁丒姡憞偡傞丅 乮摨帪偵偱偒傞堎惈懱偺 係乚僯僩儘僼僞儖巁偼 悈梟惈側偺偱丄巁偲嫟偵彍嫀偝傟傞丅乯丂廂検丗丂栺侾侽倗丅
丂丂丂丂丂
丂

丂丂乮俀乯丂儖儈僲乕儖塼偺嶌惉偲 敪岝幚尡丗
丂丂嶌惉偟偨 俁乚僯僩儘僼僞儖巁傪丄恷巁僸僪儔僕儞偺宍偱嶌梡偝偣丄俆乚僯僩儘僼僞儖 僸僪儔僕僪偲偟乮僸僪儔僕儞弅崌乯丄傾儖僇儕惈偱 垷僕僠僆儞巁僫僩儕僂儉乮亖僴僀僪儘僒儖僼傽僀僩乯傪嶌梡偝偣僯僩儘婎傪娨尦偟偰 儖儈僲乕儖乮俆乚傾儈僲僼僞儖 僸僪儔僕僪乯傪摼傞丅
丂丂俁乚僯僩儘僼僞儖巁 侾倗丄 棸巁僸僪儔僕儞乮俫2俶亅俶亄俫3丒俫俽俷4亅丄俵亖侾俁侽丏侾丂侾俋丏偺俉丏偱嶌惉乯 侽丏俇倗丄 恷巁僫僩儕僂儉乮俠俫3俠俷俷俶倎丒俁俫2俷乯 侾丏係倗丄 悈乮俫2俷乯 侾倣倢丄 僌儕僙儕儞乮俠3俫8俷3丄倐倫丏俀俋侽亷丄俉係乣俉俈亾乯 俆倣倢丂傪丄娗價儞偵擖傟丄俀俀侽亷掱搙偱 俆暘娫 壛擬偡傞丅 偙偺帪丄僈儔僗娗偱娗價儞撪偵懅傪悂偒崬傫偱 敪惗偡傞悈暘傗恷巁傪旘偽偡丅(偁傞偄偼丄傾僗僺儗乕僞乕偱媧堷乯丂塼偺怓偼埫妼怓偵側傞丅
丂丂椻偊偨傜丄俀侽倣倢偺悈傪擖傟偰梟偐偟丄侾侽亾悈巁壔僫僩儕僂儉梟塼 俆倣倢傪壛偊偰丄堦扷傠夁偡傞丅乮晄梟惈偺晜梀暔摍傪彍偔乯丂傠塼乮擹偄妼怓乯偵 垷僕僠僆儞巁僫僩儕僂儉乮亖僴僀僪儘僒儖僼傽僀僩丄俶倎2俽2俷4丄傾儖僇儕惈偱嫮偄娨尦嵻丄偟傒敳偒嵻乯 俀丏俆倗傪壛偊傞偲丄娨尦斀墳偑婲偙傝丄塼偺怓偼敄偔側傞丅 偙傟傪俆暘娫幭暒偡傞丅
丂丂昘恷巁乮俠俫3俠俷俷俫乯 俀倣倢傪壛偊 巁惈偵偟丄曻椻偟偰侾侽暘偔傜偄宱偮偲 儖儈僲乕儖乮俆乚傾儈僲僼僞儖 僸僪儔僕僪丄俵亖侾俈俈丏俀丄倣倫丏佮俁俀侽亷丄悈偵晄梟丄傾儖僇儕惈梟塼偵壜梟乯偑愅弌偟偰偔傞偺偱丄偙傟傪媧堷傠夁偟偰傠巻忋偵廤傔傞丅
丂丂儖儈僲乕儖偺敪岝幚尡偼丄 偙偺傠巻偛偲 侾亾俶倎俷俫梟塼 侾侽侽倣倢偵擖傟偰梟偐偟乮傠巻偼彍偔乯丄偙傟傪 俙塼偲偡傞丅 傑偨丄僼僃儕僔傾儞壔僇儕僂儉乮亖僿僉僒僔傾僲揝乮嘨乯僇儕僂儉丄愒寣墫丄俲3俥倕乮俠俶乯6乯 侽丏俁倗丂傪悈偵梟偐偟偰侾侽侽倣倢偲偟丄偙傟偵 夁巁壔悈慺悈乮俫2俷2丄俁侽亾乯 侾倣倢 乮偁傞偄偼丄俁亾夁巁壔悈慺悈 侾侽倣倢乯傪壛偊偨塼傪丄 俛塼偲偡傞丅丂丒丒丒丂俛塼偼丄偡偖暘夝偡傞偺偱丄幚尡捈慜偵挷惍偡傞丅
丂丂俙塼偲 俛塼傪 摍検偢偮乮俀侽倣倢亄俀侽倣倢側偳乯崿偤傞偲丄崿偤偨弖娫偐傜 俆昩偐傜俈昩掱搙傑偱丄 兩亖係俇侽値倣偺惵怓偱柧傞偔敪岝偡傞丅
丂丂乽儖儈僲乕儖斀墳乿偼丄傢偢偐側寣塼偵傕斀墳偡傞偺偱丄娪幆摍偵梡偄傜傟傞丅 愒寣墫傗寣塼偼怗攠偲偟偰嶌梡丅丂夁巁壔悈慺偺戙傢傝偵 師垷墫慺巁僫僩儕僂儉偱傕偱偒傞丅
丂丂

丂丂俁丏丂傾僝怓慺偺幚尡丗
丂丂傾僝怓慺偼丄傾僝婎丂 亅俶亖俶亅 傪帩偮怓慺偱丄摿偵丄栘柸乮傕傔傫乯椶偺巁惈愼椏偲偟偰旕忢偵懡偔偺庬椶偑梡偄傜傟偰偄傞丅 墿怓偐傜愒宯摑偺抔怓宯偑懡偄丅
丂丂傑偢 僕傾僝僯僂儉墫傪嶌傝丄師偵丄丂侾乯丂僼僃僲乕儖椶偲僇僢僾儕儞僌偡傞 僆僉僔傾僝壔崌暔乮巁惈怓慺乯偲丄丂俀乯丂戞俁傾儈儞偲僇僢僾儕儞僌偡傞傾儈僲傾僝壔崌暔乮墫婎惈怓慺乯丂偵戝暿偝傟傞丅丂偙偙偱偼慜幰偺 僼僃僲乕儖椶偲偺僇僢僾儕儞僌偺幚尡傪偡傞丅
丂丂乮 拲乯丂僕傾僝婎偼 亖俶2丂乮俶亅亖俶亄亖乯 偱丄 墫壔儀儞僛儞僕傾僝僯僂儉丂俠6俫5亅俶亄佭俶丒俠倢亅丂側偳丅 暘夝偟傗偡偄丅乯
丂丂傑偢丄墫壔儀儞僛儞僕傾僝僯僂儉傪嶌傞丅丂傾僯儕儞墫巁墫乮墫巁傾僯儕儞丄俠6俫5俶俫3亄俠倢亅丄俵亖侾俀俋丏俇丄 侾俋丏偺俆丏偱嶌惉乯 侾倗傪 俀俆倣倢偺椻悈偵梟偐偟丄昘悈偱俆亷埲壓偵椻媝偟側偑傜 垷徤巁僫僩儕僂儉乮俶倎俶俷2丄俵亖俇俋丏侽乯 俆倗傪 俆侽倣倢偺椻悈偵梟偐偟丄俀俵 墫巁乮俫俠倢乯 侾侽倣倢 偲崿偤崌傢偣偰丄墫壔儀儞僛儞僕傾僝僯僂儉偺梟塼傪嶌偭偰偍偔丅 乮壏搙偑崅偄偲丄拏慺僈僗乮俶2乯偲僼僃僲乕儖偵暘夝偡傞丅乯
丂丂師偵丄俀乚僫僼僩乕儖乮兝乚僫僼僩乕儖丄俠10俫7俷俫丄俵亖侾係係丏俀丄倣倫丏佮侾俀俀亷丄梟夝搙丗侽丏俈係倗/俴悈乯 侽丏俆倗傪 俇俵悈巁壔僫僩儕僂儉乮俶倎俷俫乯 侾侽倣倢偵梟偐偟丄悈侾侽倣倢傪壛偊偰偍偔丅丂偙偺俀乚僫僼僩乕儖俶倎 偺梟塼傪丄僈乕僛摍 傕傔傫偺晍偵揾晍偟丄 忋偺 墫壔儀儞僛儞僕傾僝僯僂儉偺梟塼傪偐偗傞乮傑偨偼丄僗僾儗乕偡傞乯偲丄捈偪偵僇僢僾儕儞僌偟偰丄侾乚僼僃僯儖傾僝亅俀乚僫僼僩乕儖乮僗乕僟儞儗僢僪嘥乯偺 愒烌怓偵愼傑傞丅乮伀嵍乯
丂丂嵟傕娙扨側僼僃僲乕儖偲墫壔儀儞僛儞僕傾僝僯僂儉偱偼丄墿怓偺愼怓偑乮伀塃乯丄 侾乚僫僼僩乕儖乮兛乚僫僼僩乕儖乯偲墫壔儀儞僛儞僕傾僝僯僂儉偱偼丄埫愒怓偺愼怓偲側傞丅
丂丂仏丂傾僯儕儞偺戙傢傝偵丄俀丆係乚僉僔儕僕儞側偳偺僕傾僝僯僂儉墫偺傎偆傪曄偊偰丄僗乕僟儞嘦丄摍偲側傞丅
丂
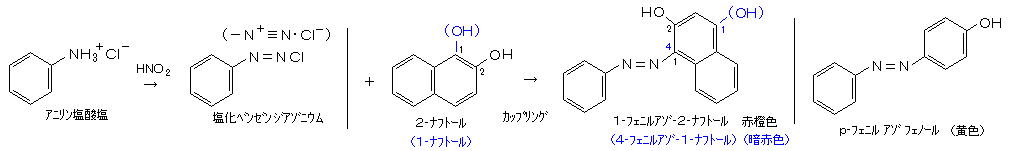

丂丂倫乚僯僩儘傾僯儕儞乮侾俋丏 俈丏偱嶌惉乯偺僕傾僝僯僂儉墫偲 俀乚僫僼僩乕儖偲偺僇僢僾儕儞僌乮俆亷埲壓乯偱偼悈偵晄梟惈偺 倫乚僯僩儘傾僯儕儞儗僢僪偑偱偒傞丅丂偙傟偼楌巎忋丄栘柸慇堐忋偵悈偵梟偗偵偔偄乮亖愻戵偱棊偪偵偔偄乯傾僝怓慺傪捈愙偮偗傞 嵟弶偺惉岟椺偲側偭偨丅丂愭偵俀乚僫僼僩乕儖梟塼傪晍偵揾晍偟偰姡偐偟丄僕傾僝僯僂儉墫梟塼傪暚柖偡傞丅乮伀嵍乯
丂丂傑偨丄倫俫巜帵栻偺 儊僠儖僆儗儞僕傕丄傾僝怓慺偺堦偮偱丄悈梟惈丅乮倫俫曄怓堟丗丂俁丏侾亅係丏係乯
丂
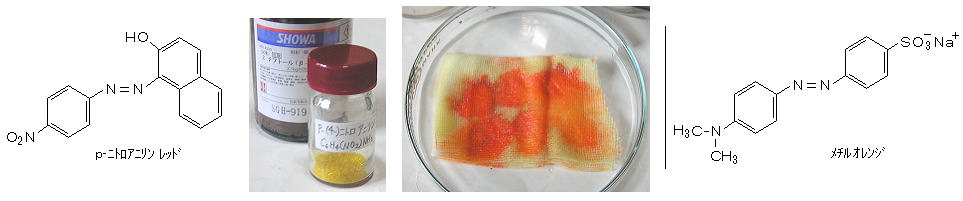
丂丂係丏丂僩儕僼僃僯儖儊僞儞宯怓慺偺幚尡丗丂乮捛婰乯
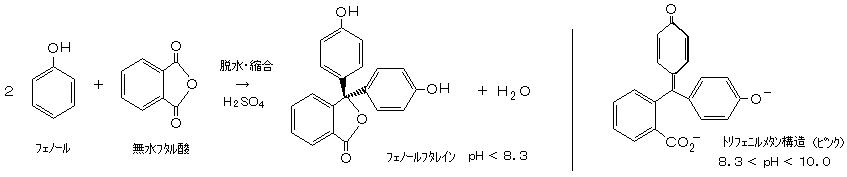
丂丂僩儕僼僃僯儖儊僞儞乮乮俠6俫5乯3俠俫乯偺婎杮峔憿偵丄僆僉僔婎乮亅俷俫乯傗傾儈僲婎乮亅俶俫2乯側偳偑摫擖偝傟偨傕偺偱丄僼僋僔儞乮儅僕僃儞僞丄儘乕僘傾僯儕儞乯丄僷儔僼僋僔儞丄儅儔僇僀僩僌儕乕儞丄傾僯儕儞僽儖乕側偳偑偁傝丄僼僃僲乕儖僼僞儗僀儞偺 庛傾儖僇儕惈偺宍傕偙傟偵側傞丅乮侾丏乮侾乯乯丂堦斒偵丄寴楽搙偼掅偔丄巁傾儖僇儕偵庛偄偑丄怓挷偼慛柧丅丂僞儞僯儞巁揝乮嘦乯僄儅儖僕儑儞偵愼椏傪壛偊偰 僀儞僉偑嶌傜傟偰偄傞丅
丂丂乮侾乯丂僷儔僼僋僔儞乮僷儔 儅僛儞僞丄僷儔 儘乕僘傾僯儕儞乯偺嶌惉幚尡丗
丂丂嘆丂倫乚僩儖僀僕儞偺嶌惉丗
丂丂僩儖僄儞偺僯僩儘壔偼丄儀儞僛儞傛傝傕偼傞偐偵恑傒傗偡偄偺偱丄昘悈偱椻傗偟偰拲堄偟偰峴側偆丅 傑偨丄堎惈懱偑奺妱崌偱偱偒傞偺偱丄搥寢偟偰暘棧偡傞丅
丂丂徤巁 俉侽倣倢丄棸巁 侾侽侽倣倢 傪崿偤偨崿巁傪偁傜偐偠傔嶌偭偰偍偒昘壏傑偱椻傗偟偰偍偔丅丂僼儔僗僐偵擖傟偨 僩儖僄儞 俉係倣倢 偵丄昘梺拞偱侾侽亷埲壓偵曐偪丄奾漚偟側偑傜 俁侽暘偐偗偰揌壓偡傞丅丂偝傜偵棳偟偱昘梺偵捫偗傞偙偲偲丄僼儔僗僐傪怳傝崿偤乮 拲乯 僑儉庤戃傪偡傞乯傞偙偲傪岎屳偵孞傝曉偟丄愒妼怓偑 墿怓偵側傞傑偱懕偗乮栺侾帪娫乯丄偝傜偵丄墿怓偔側偭偰偐傜傕幒壏偱俁侽暘怳傝崿偤傞丅丂惷抲偡傞偲塼偼俀憌偵暘偐傟傞偺偱丄暘塼楻搇偱忋偺憌傪庢傝丄壓偺巁偼幪偰傞丅乮幪偰傞巁偼懡検偺廳憘偱拞榓偺帠乯丂丒丒丒丒丒丂倫乚僯僩儘僩儖僄儞 俁俆亅俆俆亾丄 倣乚僯僩儘僩儖僄儞 亙俆亾丄 倧乚僯僩儘僩儖僄儞 係侽亅俇侽亾丂偺崿崌塼偲側傞
丂丂塼傪嵞搙暘塼楻搇偵擖傟丄悈偱俀夞愻偄丄朞榓廳憘悈偱侾夞愻偭偰丄偡傋偰壓偺憌傪庢傝丄墫僇儖偱怳傝崿偤丄傛偔姡憞偡傞丅
丂丂偙傟傪傠夁偟偰丄侾侽侽倣倢價乕僇乕偵擖傟偰 亅侾侽亷偵椻搥偡傞偲丄寢徎壔偡傞丅丂偙傟傪傊傜偱偐偒弌偟 媧堷僈儔僗傠夁婍乮侾侽侽倣倢乯偱忢壏偱寢徎偺惉暘偩偗傪庢傞丅亖僷儔僯僩儘僩儖僄儞乮倣倫丏俆侾丏俈亷乯丂乮們倖丏 倣乚丂侾俆亷丄丂倧乚丂亅俋丏俁亷丄丂倐倫丏偼偡傋偰 俀俀侽亅俀俁俉亷偱 暘棷偼晄壜擻乯丂丂偙偺 椻搥亅媧堷傠夁 傪俁夞孞傝曉偟偰丄寢徎傪庢傞丅丂寢徎偼丄悈偱愻忩偟丄僨僔働乕僞乕偱姡憞偝偣傞丅乮栺侾俆倗乯丂巆塼偼丄掅梈揰偺倧乚僯僩儘僩儖僄儞偑庡惉暘偲側傝丄屻偺幚尡偺偨傔偵暿搑 曐懚偟偰偍偔丅

丂丂師偵丄倫乚僯僩儘僩儖僄儞傪庎亅墫巁偱娨尦偟偰丄倫乚僩儖僀僕儞傪嶌惉偡傞丅
丂丂僼儔僗僐偵丄忋婰偺 倫乚僯僩儘僩儖僄儞 侾俆倗丄 庎棻乮俽値乯 俀侽倗乮夁忚検乯傪擖傟丄擹墫巁乮俫俠倢丄俁俆亾丄俵俁俇丏俆丄兿侾丏侾俉乯 俆侽倣倢傪丄傗傗壏傔側偑傜彮偟偢偮揌壓偟偰 怳傝崿偤傞丅敪擬丒暒摣偡傞応崌偼椻悈偱椻傗偡丅 斀墳偑廔傢傞偲丄僯僩儘僩儖僄儞憌偑徚偊偰堦憌偵側傞丅
丂丂偙傟偵 悈巁壔僫僩儕僂儉乮俶倎俷俫 俋俇亾乯 俀俀倗傪 俉侽倣倢悈偵梟偐偟偰椻傗偟偰偍偄偨塼傪 彮偟偢偮壛偊丄拞榓偲摨帪偵偁傞掱搙庎巁傪梟偐偟偰丄僩儖僀僕儞傪梀棧偟偨忬懺偵偡傞丅 偙傟傪俀俆侽倣倢暘塼楻搇偵擖傟丄傑偩壏偐偄偆偪偵丄忋偵晜偄偨 僆儗儞僕怓偺桘暘傪庢傞丅乮栺俋倗乯丂忢壏埲壓偵椻傗偡偲戝晹暘偑屌壔偡傞偺偱丄媧堷傠夁偟偰 屌宍偺 倫乚僩儖僀僕儞乮倣倫丏係俁亷乯偩偗傪庢傝弌偟丄偝傜偵 傠巻偺娫偵嫴傫偱墴偟偰丄塼懱憌傪庢傝彍偔丅乮栺俁倗乯丂倫乚僩儖僀僕儞偼巁壔偝傟偰妼怓偵側傝傗偡偄偺偱丄憗傔偵巊偄愗傞丅丂乮們倖丏 倧乚僩儖僀僕儞丗丂倣倫丏亅俀俁亷丄丂倧乚僩儖僀僕儞偼 敪偑傫惈乮銷泖偑傫乯側偺偱丄忲婥摍傪媧偄崬傑側偄傛偆偵拲堄丅 倧乚僯僩儘僩儖僄儞偼娨尦偟側偄帠乯
丂丂

丂丂嘇丂僷儔僼僋僔儞偺崌惉丗
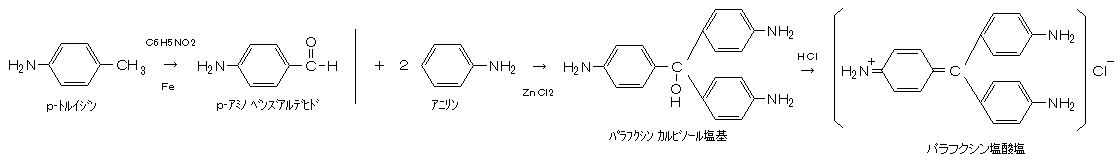
丂丂倫乚僩儖僀僕儞乮倫乚俠6俫4乮俶俫2乯俠俫3乯 侽丏俉倗丄 傾僯儕儞墫巁墫乮侾俋丏俆丏乯 俀丏侽倗丄 墫壔垷墧乮倅値俠倢2丄丒丒丒弅崌丒扙悈嵻乯 俁丏侽倗丄 僯僩儘儀儞僛儞乮侾俉丏侾丏丄俠6俫5俶俷2丄丒丒丒僩儖僀僕儞偺巁壔嵻乯 俆倣倢丄 揝暡乮俥倕丄丒丒丒怗攠乯 侽丏俆倗丂傪丄懢帋尡娗偵擖傟丄帪乆偐偒崿偤側偑傜栺侾俇侽亷偱 俀帪娫壛擬偡傞丅 倫乚僩儖僀僕儞偼丄僯僩儘儀儞僛儞偵傛偭偰 堦搙丄倫乚傾儈僲儀儞僘傾儖僨僸僪偵巁壔偝傟丄俀暘巕偺傾僯儕儞偲弅崌偟偰丄僷儔僼僋僔儞墫巁墫偵側傞丅
丂丂僷儔僼僋僔儞墫巁墫偼丄梟夝搙偑 侾倗/侾侽侽倣倢悈乮俀俆亷乯側偺偱丄俇俶 墫巁 俆倣倢壛偊偨俁侽侽倣倢偺擬悈偱梟偐偟弌偟丄忢壏偱 値乚僿僉僒儞俆侽倣倢偲怳偭偰 枹斀墳偺桘暘傪彍偒丄傠夁偟偰偐傜丄幭媗傔偰僔儘僢僾忬偵偡傞丅丂偙傟傪忲敪嶮偵擖傟偰丄僔儕僇僎儖偲惗愇奃傪擖傟偨僞僢僷乕偵擖傟偰丄堦斢 姡憞偝偣傞丅丂偝傜偵丄弌偰偒偨寢徎埲奜偺梟塼傪幪偰丄寢徎傪偐偒弌偟丄傠巻亄僉僢僠儞儁乕僷乕偺忋偵俀亅俁擔抲偄偰 挭夝惈偺晄弮暔乮倅値俠倢丄墫巁傾僯儕儞側偳乯傪偟傒偙傑偣偰彍偒丄僷儔僼僋僔儞墫巁墫乮亖墫婎惈僷儔僼僋僔儞丄僷儔 儅僛儞僞丄僷儔 儘乕僘傾僯儕儞乯偺姡憞寢徎乮椢怓岝戲偺巼怓乯傪摼傞丅
丂丂丂
